2014中国早期胃癌筛查及内镜诊治共识意见(2)
作者:李兆申 王贵齐 张澍田 来源:中华消化内镜杂志
四、危险因素
胃癌的发生是多因素参与、多步骤演变的复杂病理过程,是人口学因素、生活饮食因素、遗传基因、感染因素和环境因素等相互作用的综合结果。对胃癌病因学和危险因素的研究不仅有利于胃癌的一级预防,更为正确区分胃癌高危人群,有针对性地进行二级预防提供了重要依据。
(一)胃癌的危险因素
1.人口学因素:年龄和性别等人口学因素是胃癌的危险因素。随着年龄增长,胃癌发病率和死亡率也随之增加,我国在40岁后发病率明显上升,达到峰值后逐渐缓慢下降,30岁以下发病病例较为少见;30岁前胃癌死亡病例很少见,40岁以后胃癌死亡明显增加,并随年龄增长死亡率亦上升。
世界各国胃癌发病率和死亡率均为男性高于女性,2008年LARC数据显示胃癌的男女比例为1.8:1,男女发病比例在不同国家范围为(1.1-2. 3):1,胃癌发病率高的地区男女比值也相对较高。我国按累积发病率和死亡率计算男性约为女性的2倍。男高女低的趋势并不取决于吸烟差异,遗传因素及其他外源因素(如性激素分泌差异,饮食习惯及行为差异等)的影响可能导致了胃癌分布的性别差异。
2.生活饮食因素:
(1)高盐饮食:高盐饮食与胃癌的发病率和死亡率升高有关,日本一项大型前瞻性随访研究发现每日摄盐超过10 g明显增加胃癌发病率,且伴HPylori感染的萎缩性胃炎患者与胃癌联系更明显。高盐饮食不仅可直接损伤胃黏膜,增加机体对致癌物的易感性,而且高盐食物中含大量硝酸盐,在胃内被还原并与食物中的胺结合后形成亚硝酸胺等N-亚硝基化合物。一项在24个国家39组人群进行的生态学研究发现,男女胃癌死亡率与钠和硝酸盐均显著相关,且与钠的关系较硝酸盐更强。
(2)腌熏煎烤炸食品:此类食品会产生多环芳烃、N-亚硝基化合物等致癌物,在冰岛、日本、乌拉圭及我国少数民族地区的多项研究中显示出其与胃癌关系密切。
(3)不良饮食习惯:不良饮食习惯会导致胃黏膜反复损伤修复,降低胃黏膜的保护作用,长期作用可引发癌变。一项Meta分析提示中国人不吃早餐、饮食不规律、吃饭速度快、暴饮暴食、吃剩饭菜是胃癌的危险因素。
(4)吸烟:多项前瞻性研究发现,吸烟与胃癌发生风险呈剂量反应关系,胃癌风险随每日吸烟量及时长的增加而增加,且与胃癌的复发和死亡升高相关。
(5)饮酒:酒精可损伤胃黏膜,但对胃癌的影响尚无定论,且与酒的类别、饮用量及时长相关。
3.感染因素:上世纪90年代,国际癌症研究机构IARC、WHO均将HPylori划归I类致癌因子。Meta分析表明,H.Pylori感染可使胃癌发生风险增加2倍。一项前瞻性研究发现2. 9%的HPylori阳性患者最终进展为胃癌,而H Pylori阴性患者无一例发展为胃癌。
12项巢式病例对照研究的汇集分析结果显示,H.Pylori阳性人群中非贲门部胃癌的发病率是HPylori阴性人群的2.97倍。世界人口虽有20亿人感染的H.Pylori,但不到1%的HPylori感染人口最终发展为胃癌,说明H Pylori感染并非胃癌发生的充分条件,胃癌发生是细菌毒力因子与宿主炎症相关的遗传学背景及环境等一系列因素相互作用的结果。
多种H Pylori毒力因子,如毒力基因岛( cagA)、空泡毒素(VacA)、部分粘附素和外膜蛋白( OMP)参与胃癌发生过程。尽管如此,MaastrichtⅣ共识报告认为目前尚无特殊的细菌毒力因子标志可用于临床,H Pylori感染是胃癌最重要的危险因素,根除H Pylori将是减少胃癌发病率最有希望的策略。根除HPylori能否降低胃癌死亡率,有效减少萎缩和肠化以及内镜下切除早期胃癌后根除HPylori能否预防异时癌发生,研究结果尚不一致,有待进一步研究证实。
4.遗传因素:流行病学资料提示部分胃癌有家族聚集倾向,其中遗传性弥漫性胃癌(约占胃癌总数的1%-3%)是由编码E-钙黏蛋白(E-cadherin)的CDH1基因突变引起,种系突变携带者一生中有80%的概率发生遗传性浸润性胃癌。其他家族性疾病中也伴发胃癌发病风险升高,如Lynch综合征、家族性腺瘤性息肉病等。
因突变明确的遗传性胃癌比例低,散发性胃癌的遗传因素更受关注。近年全基因组关联研究发现了弥漫型胃癌、贲门癌和胃体癌的部分易感位点,揭示了胃癌的复杂性及其亚型间遗传异质性的存在,但具体机制和临床意义尚待研究。散发性胃癌患者一级亲属的遗传易感性较高,这种遗传易感性虽难以改变,但根除H Pylori可以消除胃癌发病的重要因素,从而提高预防效果。
5.其他因素:地质、饮用水等环境因素可能通过与遗传背景、H Pylori感染、宿主免疫等交互作用影响胃癌的发生。精神心理社会因素(如精神刺激或抑郁)、免疫因素等可能与胃癌发生有一定关联,是否为确证的危险因素还需进一步研究。人群对胃癌防治知识的认知度也是影响胃癌早诊早治重要因素。
6.保护因素:水果和蔬菜摄人是胃癌的保护因素:一项大规模前瞻性研究发现,相比每日摄入水果蔬菜低摄入组,高摄入组的胃癌发生风险降低44% ,近期有Meta分析显示摄入膳食纤维与胃癌风险呈负相关,食用葱蒜类蔬菜也可减少胃癌发生。关于绿茶与胃癌相关性的Meta分析尚未得出倾向性结论。部分流行病学研究发现维生素C、类胡箩卜素、维生素E及微量元素硒等与胃癌风险呈负相关,但RCT结论尚不统一。食物冷藏技术如冰箱的使用率上升与胃癌风险下降有一定关联。
(二)胃癌的报警症状
报警症状包括:消化道出血、呕吐、消瘦、上腹部不适、上腹部肿块等。报警症状对胃癌的预测作用目前尚有争议:我国台湾地区一项研究显示,对有消化不良症状患者,如为45岁以下,无消瘦、吞咽困难和消化道出血等报警症状,上消化道癌的阴性似然比很低,肯定了部分报警症状的价值。
伊朗一项研究提示,食管癌或胃癌与年龄较大、男性、消瘦、呕吐相关,但单独的报警症状作用有限。使用年龄、报警症状和吸烟状态联合区分高危和低危人群,ROC曲线下面积达到0. 85,但仍有癌症漏诊,建议如有条件,对消化不良的高龄人群或近期有明显消瘦尽早行内镜检查。
国内大规模单中心对超过10万例高H Pylori感染背景人群内镜资料分析后得出,除吞咽困难和年龄外,其他症状对上消化道癌的预测作用有限,而对胃癌来说,报警症状的作用都非常有限。在我国,有无报警症状并不能作为是否行内镜检查的决策指标,考虑到在有报警症状的人群中单独使用H Py-lori“检测和治疗”策略漏检肿瘤风险大,不推荐使用,结合我国内镜检查费用相对较低,普及率高,胃癌发病率高的现状,对有消化道症状的患者建议行胃镜检查排除胃癌等上消化道肿瘤。
五、病理学
1.早期胃癌病理学分型:胃癌的病理分型比较常用的为Lauren和WHO分型,其中我国在诊断病理领域大多遵循WHO分型方案。WHO分型中胃癌包括以下常见组织学类型:乳头状腺癌、管状腺癌、黏液腺癌、印戒细胞癌、腺鳞癌、鳞癌、小细胞癌、未分化癌。其中管状腺癌还可进一步分成高分化、中分化、低分化腺癌。此外尚有少见类型或特殊类型胃癌。
2.早期胃癌浸润深度分类:早期胃癌根据其浸润的层次又可细分为黏膜内癌( M-carcinoma,MC)和黏膜下癌(SM-carcmoma.SMC)。MC又可分为Ml(上皮内癌和/或黏膜内癌仅浸润固有膜表层)、M2(癌组织浸润固有膜中层)和M3(癌组织浸润固有膜深层或黏膜肌层),SMC又可分为SM1(癌组织浸润黏膜下层上1/3)、SM2(癌组织浸润黏膜下层中1/3)和SM3(癌组织浸润黏膜下层下1/3)。对于黏膜切除标本,SMl-c是指癌组织浸润黏膜下层的深度小于500 um。
六、筛查( screening)
胃癌在一般人群中发病率较低(33/10万),且目前尚无简便、有效的诊断方法进行全体人群普查。内镜检查等诊断方法用于胃癌普查需要消耗大量的人力、物力,且由于其是侵入性检查,很多无症状、低胃癌发病风险的患者难以接受,即使日本、韩国等胃癌发病率较高的发达国家也无法对全体人群进行胃癌普查。因此,只有针对胃癌高危人群进行筛查,才是可能行之有效的方法。
(一)筛查对象
胃癌的发病率随年龄增长而升高,40岁以下人群发病率较低。多数亚洲国家设定40-45岁为胃癌筛查的起始临界年龄,胃癌高发地区如日本、韩国等胃癌筛查提前至40岁。我国40岁以上人群胃癌发生率显著上升,因此建议以40岁为胃癌筛查的起始年龄。约半数患者可无报警症状,45岁以下患者发生报警症状的比例更低,因此不应因无报警症状而排除筛查对象。约10%的胃癌表现为家族聚集性,胃癌患者亲属胃癌发病率较无胃癌家族史者高4倍。
根据我国国情和胃癌流行病学,以下符合第1条和2-6中任一条者均应列为胃癌高危人群,建议作为筛查对象:(1)年龄40岁以上,男女不限;(2)胃癌高发地区人群;(3)H Pylori感染者;(4)既往患有慢性萎缩性胃炎、胃溃疡、胃息肉、手术后残胃、肥厚性胃炎、恶性贫血等胃癌前疾病;(5)胃癌患者一级亲属;(6)存在胃癌其它高危因素(高盐、腌制饮食、吸烟、重度饮酒等)。
(二)筛查方法
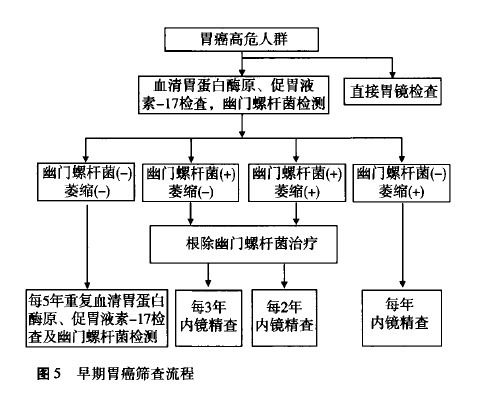
1.血清胃蛋白酶原( pepsinogen,PG)检测:PG I浓度和(或)PG I/PGⅡ比值下降对于萎缩性胃炎具有提示作用,通常使用PGI浓度≤70 ug/L且PG I/PGⅡ≤3.0作为诊断萎缩性胃炎的临界值,国内高发区胃癌筛查采用PG I浓度≤70 ug/L且PC I/PGⅡ≤7.0。根据血清PG检测和H Pylori抗体检测结果可以有效对患者的胃癌患病风险进行分层,并决定进一步检查策略。
根据胃癌风险分级,A级:PG(-)、HPylori(-)患者可不行内镜检查;B级:PC(-)、HPylori(+)患者至少每3年行1次内镜检查;C级:PG(+)、H Pylori(+)患者至少每2年行1次内镜检查;D级:PG(+)、H Pylon:(-)患者应每年行1次内镜检查。但需要注意的是当萎缩仅局限于胃窦时,PG I及PG I/PGⅡ比值正常。血清PC水平在短时间内较为稳定,可每5年左右重复进行检测。本部分检测不针对胃食管交界癌(贲门癌)。
2.胃泌素17(gastrin-17,G-17):血清C-17检测可以反映胃窦部黏膜萎缩情况。血清G-17水平取决于胃内酸度及胃窦部G细胞数量。因此,高胃酸以及胃窦部萎缩患者的空腹血清G-17浓度较低。与血清PC检测相结合,血清G-17浓度检测可以诊断胃窦(G-17水平降低)或仅局限于胃体(G-17水平升高)的萎缩性胃炎。因此,建议联合检测血清C-17、PC I、PG I/PGⅡ比值及HPylori抗体,以增加评估胃黏膜萎缩范围及程度的准确性。
3.上消化道钡餐:日本自1960年起应用X线钡餐检查进行胃癌筛查。最初检查应用8组小X光片,如有异常再进行更详细的11组X光片检查。如果X线钡餐检查发现可疑病变如胃腔直径减小、狭窄、变形、僵硬、压迹、龛影、充盈缺损、黏膜褶皱变化等则行进一步内镜检查。然而,随着内镜技术的快速发展,内镜检查已基本取代X线钡餐检查,成为最常用的胃癌检查手段。在我国,结合医院实际情况,也可酌情考虑使用上消化道X线钡餐检查进行筛查。
4.内镜筛查:内镜及内镜下活检是目前诊断胃癌的金标准,尤其是对平坦型和非溃疡性胃癌的检出率高于X线钡餐等方法。然而内镜检查依赖设备和内镜医师资源,并且内镜检查费用相对较高、具有一定痛苦,患者接受程度较差,即使对于日本等发达国家而言,也尚未采用内镜进行大规模胃癌筛查。因此,采用非侵入性诊断方法筛选出胃癌高风险人群,继而进行有目的的内镜下精查是较为可行的诊断策略(图5)。